流行病防范創新聯盟(Coalition for Epidemic Preparedness Innovations, CEPI)提出了一個“100天任務”,或“登月”計劃,將從病原體鑒定到推出新疫苗的時間壓縮到100天。與此同時,還認識到第二個100天的重要性,即大規模推出一種新疫苗。具有已知安全性、免疫原性、生產和分發特征的疫苗平臺技術對于應對這些挑戰至關重要。
新疫苗的臨床前和臨床開發的許多特點是獨立于平臺技術的。在基于不同平臺部署疫苗的途徑中,生產和分發是主要的分歧點。在這里,我們表明,腺病毒載體疫苗的“快速響應”生產可以縮短開發時間表,與其它平臺競爭,在此,我們將討論改進疫苗生產對未來疫情應對和公平獲得疫苗的影響。
腺病毒載體提供了一個快速適應和可部署的平臺,具有經過驗證的安全性和有效性,在實現公平獲取方面具有特別優勢。牛津大學和阿斯利康基于黑猩猩腺病毒平臺開發的Vaxzevria (ChAdOx1 nCoV-19) COVID-19疫苗估計在2021年挽救了約600萬人的生命。對79項實際有效性研究的回顧證實了其對死亡或嚴重疾病的高療效。伴血小板減少綜合征的血栓形成在腺病毒載體疫苗接種者中很少發生,在歐洲和北美以外的數據集中更為罕見。在許多情況下 - 包括對高死亡率病原體的應急反應和沒有現有疫苗的情況下 - 這種綜合征的發生頻率對疫苗接種的風險/效益平衡影響不大。
我們與阿斯利康和其它工業合作伙伴一起開發了一種簡單的生產工藝,在五大洲12個國家的設施網絡中生產了30多億劑。生產成本低,而且疫苗適合冷藏而不是冷凍儲存,因此能夠向難以獲得服務的社區,特別是中低收入國家,分發疫苗。
然而,除了這些積極的特征外,腺病毒生產也有兩個明顯的缺點。首先,準備病毒種子作為生產的起始材料所花費的時間延遲了臨床試驗的首批可用性。2020年,在病原體序列發表63天后,首次在人體中使用了mRNA SARS-CoV-2疫苗。第一批ChAdOx1 nCoV-19臨床批次直到一個月后才放行。其次,mRNA疫苗的單位體積生產力 (每升生物反應器容量的劑量數) 估計至少比ChAdOx1 nCoV-19疫苗每升大約2000劑的數值高一個數量級。這就需要更大的“占地”來生產腺病毒載體原料藥 (疫苗原液)。
我們最近發表了一篇文章,試圖解決這些問題。我們表明,簡化病毒種子生產可以在新病原體序列可用的60天內放行第一批用于臨床試驗的疫苗批次,并在100天內放行第一批大規模商業批次 (圖1a)。我們還發現,與商業化生產ChAdOx1 nCoV-19的工藝相比,強化上游工藝 (即細胞培養和病毒復制) 可以使單位體積生產力提高四倍。改進后的工藝每升生物反應器培養產生約8 × 10^14純化原料藥病毒顆粒(VP),足以生產>10,000劑藥品。
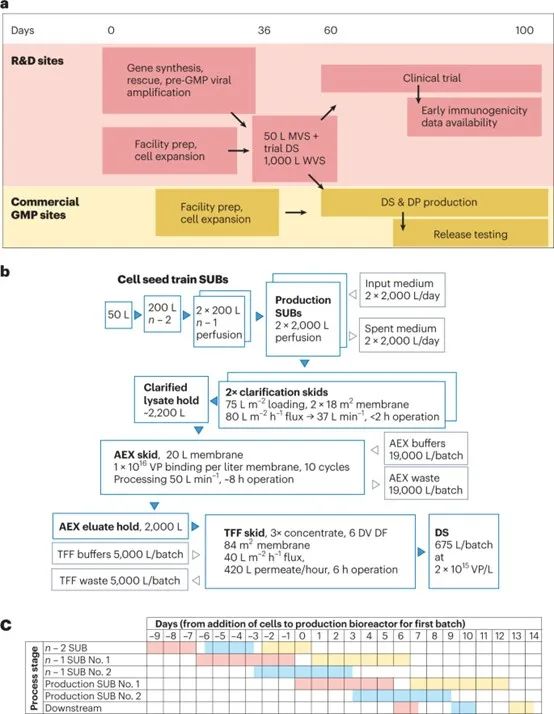
圖1:加速高產量腺病毒生產。a.開發活動的高水平概述,包括種子生產、臨床試驗疫苗供應、臨床試驗執行和大規模生產,從而能夠在第100天放行第一批商業規模的批次。b、設備、產品和物料在模擬設施中的流動。c、生產計劃說明,顯示使用兩個n - 1反應器,兩個生產生物反應器和一個下游純化鏈。粉色、藍色和黃色分別表示第一批、第二批和第三批。
我們現在描述這種改進的生產工藝的商業規模實施的技術經濟模型 (圖1b)。使用Biosolve Process 8軟件(Biopharm Services) 構建和評估模型。我們模擬了一個設施,該設施使用一個200 L的“n- 2”生物反應器,用于交替接種兩個200 L灌注 “n- 1”生物反應器,依次為兩個2000 L生產生物反應器和一個下游純化裝置提供服務。以下假設基于我們發表的數據:細胞倍增時間36 h;上游工藝生產率1.5 × 10^12 VP/mL;收獲時benzonase核酸酶濃度100 units/mL;澄清過濾器上樣可達1 × 10^12 cells/m2,對應75 L/m2,峰值細胞密度1 × 10^7 cells/mL,安全系數為33%;澄清產物回收率66%;陰離子交換膜結合容量1 × 10^16 VP/L;陰離子交換回收率90%;切向流過濾過濾器上樣2 × 10^16 VP/m2。切向流過濾階段的濃度限制在生物反應器體積的0.33倍,對應于2.2 × 10^12 VP/mL的預期產物濃度。成本基于賽多利斯和Biosolve的專有數據庫。
這種生物反應器配置可以每3.5天提供一批 (圖1c)。與缺乏種子灌流擴增和使用一次性生產生物反應器的設施相比,這一設施的產量增加了一倍以上。在n - 1條件下使用灌流使細胞擴增更多,減少了生產生物反應器的周期時間。一個純化鏈仍然足以處理兩個生產反應器的輸出。下游工藝可以通過對用于全球生產ChAdOx1 nCoV-19的設備進行適度修改來執行。雖然與其它工藝階段相比,AEX所需的緩沖液體積很大,但對于許多設施來說,通過使用緩沖濃縮液和在線稀釋技術,這些緩沖液可能是可控的。到目前為止,我們還沒有優化最終的切向流過濾,以最小化所需的膜面積,我們的模型基于我們未優化的經驗,使用了謹慎的假設。預計每批切向流過濾膜面積為84 m2,這突出了這種優化的必要性,但仍然可以使用定制的切向流過濾系統或在現成的系統上進行多次循環來實現。
假設設施使用率為70%,預計單個這樣的設施每年可生產約13億劑,原料藥成本低于每劑0.11美元 (低于用于生產ChAdOx1 nCoV-19的補料分批工藝)。這相當于每天每升生物反應器容量大約輸出900劑。建造和裝備這一設施的資本支出約為4300萬美元,每年的業務支出不到1.1億美元。
在應急響應的短期最大產能運行的替代假設下,我們估計8個這樣的設施(即已安裝的生物反應器總產能為32,000 L)每月可提供總共10億劑。雖然規模很大,但這將小于2021年生產ChAdOx1 nCoV-19的設施網絡。我們認為,一些現有設施 (包括一些低收入和中等收入國家的設施) 將是合適的。
這些結果對防范未來的大流行具有若干意義。
在我們改進腺病毒生產平臺的工作中,我們最初專注于三個基于時間的指標:從病原體序列可用性到放行第一批臨床試驗批次、第一批商業批次和第10億劑的時間。與2020年的情況相比,我們認為腺病毒生產和其它平臺技術現在都有能力滿足CEPI“100天”的目標。在比這短得多的時間內完成臨床前和臨床開發似乎不太可能。在第二個一百天內,我們的模型表明,一個準備充分的全球努力,使用一個實際規模的生產網絡,可以放行超過30億劑。這足以為全球很大一部分人口提供第一劑疫苗,其產出水平是任何COVID-19疫苗規劃都需要兩年多才能達到的。
在2020年至2022年期間,技術上可行的疫苗生產速度發生了階段性變化。現在,實現這樣的生產速度已經不是技術可行性的問題,主要是資金和準備的問題,包括降低失敗風險和提前準備監管文件模板。在我們看來,我們所描述的工藝的一個完全驗證的版本,最好包括一個獨立的并行種子生產“備份活動”,并由快速周轉平臺分析支持,將提供更高的成功“信心”。
質量控制測試限制了疫苗的可獲得性。我們建議的時間表 (圖1a) 允許第一批臨床試驗批次的放行測試16天,第一批商業批次的測試35天。這一差異是由于對商業物料采用28天體外培養法檢測外源性病毒物質和具有復制能力的腺病毒,而對臨床試驗材料采用基于核酸的檢測 (支持14天體外檢測)。充分驗證PCR或下一代基于測序的污染物檢測方法,可以將第一批商業批次的放行提前到第80天或更早。
進一步的改進是可能的。然而,從生產的角度來看,任何疫苗平臺都可能具有競爭力,因為它能夠在100天內實現第一批商業批次,每天每升生物反應器容量生產1,000劑,并且每劑原料藥的成本< 1美元。進一步的改進可能提供相對較小的效益。領先的疫苗平臺現在已經達到了所需的生產速度和設施生產力的水平,在這種水平上,其它因素可能更為重要。這些考慮因素包括安全性、耐受性、有效性、穩定性、成本、方案適用性、個體接受者偏好以及生產商支持技術轉移的意愿。在不同情況下選擇不同的疫苗可能有合理的科學理由。
未來的流行病是不可避免的。及時獲得多種疫苗 (包括腺病毒) 對于保護公眾健康是必要的。我們認為,維持一個區域性設施網絡 “預熱” (預先配備人員、預先儲備物料和預先融資),以生產任何十億劑規模的腺病毒載體疫苗,作為一種全球公共產品,在經濟上是有吸引力的。在我們的模型的基礎上,每年可能需要花費不到2.2億美元來資助一個全球設施網絡,該網絡能夠在發現一種新的病原體后的200天內向許多國家提供10億劑腺病毒載體疫苗。這一估計是基于擁有足夠的物料和耗材庫存,以生產10億劑 (55批,每批提供約1800萬劑,物料和耗材每批約130萬美元),并每12個月更新一次庫存。一些物料和耗材的保質期將超過12個月,降低成本,但不包括倉儲成本。快速響應需要利用已有的設施 - 例如,在兩次流行病之間生產其它疫苗或生物制品的合同生產組織的設施 - 并就發生大流行時的緊急"隨叫隨到"權利合同進行談判。利用現有設施將降低資本投入和勞動力成本,盡管預計這些成本只占疫苗生產總成本的一小部分。一個關鍵的不確定因素是設施緊急可用性的費用。在兩次大流行之間,這將需要維持對工作人員的培訓和工藝驗證,可能需要間歇地執行該工藝,而且 - 至關重要的是 - 將防止使用該設施生產不允許中斷數月的產品。我們的估計是假設每個設施每年可以以大約1100萬至1600萬美元的價格獲得這種可隨時進入的能力,這在五年的時間里接近一個專門建造的設施的總資本和勞動力成本。采用類似工藝生產另一種用于非大流行適應癥的病毒載體的設施,或將八個生產鏈集中在較少數量的設施中,可能會獲得更高的成本效益。
建立這種“預熱”網絡的成本很高,但僅相當于COVID-19大流行12.5萬億美元全球成本的0.002% (據國際貨幣基金組織估計),或2021年全球COVID-19疫苗支出的0.4%左右。哪個實體可能資助和委托這樣一個腺病毒網絡或任何其它疫苗平臺,這對全球決策者來說是一個懸而未決的問題,因為這超出了CEPI支持研究和開發的核心角色。
原文:C.C.D.Joe, N.Chopra, P.Nestola, et al., Rapid-response manufacturing of adenovirus-vectored vaccines. Nature Biotechnology, 2023.






