質粒作為生物藥物
近年來基因和細胞治療行業的快速增長極大地增加了對質粒 DNA 的需求。質粒用于將編碼治療性蛋白質、RNA 或抗原的遺傳信息或基因直接遞送至患者的靶細胞(圖 1A和表 1)。此外,質粒還用作載體來遞送基因編輯系統的分子組件(例如,編輯酶、RNA向導),包括成簇規則間隔的短回文重復DNA序列(CRISPR)、鋅指核酸酶(ZFN)和轉錄激活劑樣效應核酸酶 (TALEN)。在此類體內用途中,適當的質粒與其它成分(例如佐劑、脂質等)組合以產生遞送給患者的醫藥產品。在這些應用中,質粒是生物療法,必須在現行良好生產規范 (cGMP) 下生產,并進行適當的監管、檢測和控制。
質粒作為起始材料
除了作為生物制品的作用外,質粒在工程細胞產品(圖 1Bi 和表 1)或其它生物制品(圖 1Bii 和表 1)的生產中還作為復雜的起始材料發揮著支持作用。例如,在嵌合抗原受體 T 細胞 (CAR-T) 療法、基因組編輯方法或間充質干細胞療法的背景下,質粒被用作病毒載體的替代品,對從患者或捐獻者體內提取的細胞進行基因修飾。第一個情況需要用質粒系統(例如編碼CAR基因、轉座酶等)轉染患者的T細胞,目的是實現CAR的穩定基因轉移、整合和表達。在第二種情況下,質粒用于遞送 CRISPR、TALEN 或 ZFN 等基因編輯器的分子組件。無論哪種情況,質粒修飾的細胞都會被輸回患者體內。最后,質粒還用于修飾間充質干細胞,例如增強其體內治療功能。
病毒載體和 mRNA 的生產也需要質粒,它們可以單獨用作生物制品(圖 1Bii),也可以用作患者細胞離體修飾的試劑(圖 1C 和表 1)。例如,許多腺相關病毒(AAV)和慢病毒(LV)載體是通過使用多個質粒瞬時轉染生產細胞(例如人胚腎(HEK)293T細胞)來產生的。舉個例子,AAV 顆粒的生產依賴于使用三種不同的質粒:一種 AAV 轉移質粒,其兩側帶有兩個反向末端重復序列 (ITR) 的目的基因;一種含有 AAV 基因的質粒;以及一種編碼腺病毒輔助基因的輔助質粒。同樣,通過細胞瞬時轉染來生產 LV 也需要使用三個或四個不同的質粒。然后可以將所得病毒載體施用于患者或用于離體轉導細胞。
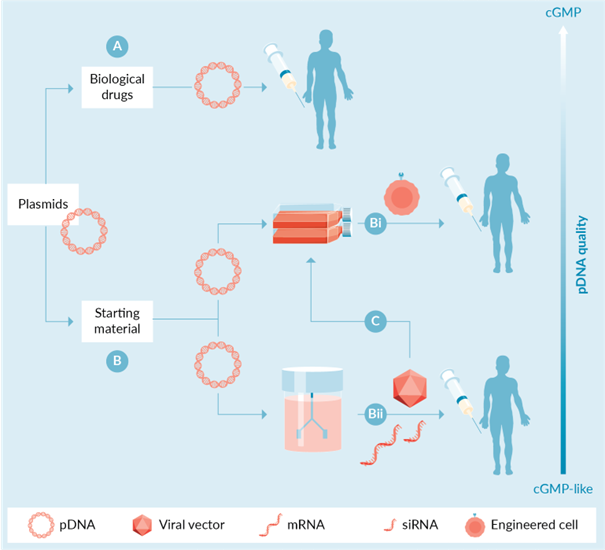
圖1 質粒DNA在基因和細胞治療中的直接和間接應用。質粒可用作 (A) 生物藥物,例如作為 DNA 疫苗或作為體內非病毒基因治療/編輯平臺的組成部分,或作為 (B) 起始材料,如 (Bi) 細胞離體基因工程的起始材料(CAR-T 細胞、CRISPR 編輯的細胞等)或用于 (Bii) 病毒載體、mRNA 以及最終 RNA 生物制品的生產。后者可以單獨用作生物制品 (Bii),或 (C) 作為患者細胞離體修飾的起始材料。
圖2 制備質粒作為生產工程細胞產品和病毒載體的起始材料。以淺紅色突出顯示的生產活動應遵循 cGMP 原則,而以深紅色突出顯示的生產活動應遵守完整的 cGMP。
新冠病毒危機引發的mRNA疫苗的出現,也為質粒創造了新的用途和激增的需求。在 mRNA 技術背景下,質粒被廣泛用于生產 mRNA 的體外轉錄 (IVT) 反應所需的模板。此類模板通常是通過純化質粒的酶線性化或使用 PCR 擴增該質粒中的目的區域來產生的。IVT 產生的 mRNA 產品隨后被進一步處理和純化,直到可以轉移給患者的階段,例如在 mRNA 疫苗接種或基因組編輯的背景下(圖 1Bii 和表 1)。此外,mRNA 產品可用于離體修飾或編輯細胞(圖 1C 和表 1)。
人們還可以預見,質粒和 IVT 策略可能會在小 RNA 分子的生產中發揮更重要的作用,例如反義寡核苷酸、RNA 向導或 siRNA 產品中使用的雙鏈 RNA。目前,固相化學合成可以生成長度長達 50-100 nt 的 RNA,由于其成本效益、自動化方案和非常短的合成周期,是大多數寡核苷酸藥物合成的首選方法。盡管如此,IVT 廣泛用于合成 RNA 分子以進行結構研究和基礎 RNA 生物學(例如剪接、核糖開關、CRISPR、lncRNA)研究,在這種情況下,其可能成為一個有吸引力的替代方案。如果這一切實現,質粒很可能在小 RNA 生產中發揮關鍵作用,就像它們在 mRNA 疫苗、治療藥物和試劑中一樣。
質粒級別
間接使用質粒 DNA 作為病毒載體或 mRNA 疫苗生產的起始材料需要生產大量材料。例如,需要超過1 kg的質粒 DNA 才能提供 10 億劑 mRNA 疫苗。由于質粒不會出現在直接給予患者的最終藥品中,而是用作其它起始物料、生物藥物或細胞產品的 cGMP 生產的起始材料,因此不嚴格要求 cGMP 等級。然而,盡管并非所有 GMP 方面或 GMP 證書都是必需的,但在生產過程中仍應遵守 GMP 原則,因為起始原料最終可能會在藥品成品中殘留,并可能影響其質量、安全性和功效。最終,開發商需要進行適當的風險分析,以確定適合在 cGMP 下進一步生產藥品的質粒 DNA 的質量標準。需要適當考慮的相關方面包括質量管理體系、文件、原材料、細胞庫、生產、規格、檢測、控制和儲存等。因此,人們可以選擇生產一種 cGMP-like/高質量的質粒 DNA,雖然不符合所有 cGMP 要求,但仍然符合許多監管建議。圖2 強調了依賴于質粒起始材料的工程細胞產品和病毒載體的生產階段,其中應采用 cGMP 和 cGMP 原則。
大規模質粒生產
盡管已經相當成熟,但大規模生產質粒 DNA 并非易事,生產商不斷地被迫尋找在不影響質量的情況下提高生產率的方法。這種提高生產性能的壓力部分源于這樣一個事實:可用產能不足以及時響應與不斷增長的質粒應用的開發相關的需求增長。
目前,質粒DNA的大規模生產僅依賴于一種平臺宿主 - 大腸桿菌。這種偏好的合理性在于大腸桿菌能夠在一系列條件下快速生長和分裂并提供高質粒 DNA 產量。此外,還有許多工具可支持大腸桿菌的分子和微生物工程,包括創建質粒載體和改良菌株。大腸桿菌的改良菌株可以生長到每升數百克的密度,每升培養物可產生高達 1-2 g 的質粒 DNA。人們還致力于開發改良的大腸桿菌菌株,這些菌株可以避免不穩定問題,例如處理含有 ITR 的質粒(例如在 AAV 轉移質粒生產過程中使用的質粒)時所面臨的不穩定問題。
提高生產過程中產生的質粒數量、簡化監管審批并改善質粒生物學功能的一種方法是專注于 DNA 主鏈的工程設計。人們一直致力于生成更小、不含抗生素抗性基因、提高產量并提供高轉基因表達的質粒和質粒系統(例如,微環、納米質粒、微載體)。
從發酵結束時回收的大腸桿菌生物質中分離和純化質粒是一項工程挑戰,但大部分已得到解決,特別是在較小規模的情況下。質粒下游工藝中使用的一系列單元操作幾乎不可避免地包括堿裂解、切向流過濾和層析步驟。使用不同的操作組合來處理具有殘留量宿主雜質(基因組 DNA、RNA、蛋白質、脂多糖等)的質粒 DNA,且符合監管要求。
尚未得到滿意解決的關鍵問題包括堿裂解的重現性差、層析中缺乏載量和亞型選擇性以及工藝過程中由于剪切導致的超螺旋亞型損失。當處理非常大的質粒時,使用 0.22 μm 過濾器進行最終的除菌過濾也可能很麻煩。
一旦生產出來,應嚴格表征從每批獲得的大量純化質粒。用作起始材料的質粒的放行規格基本上將重點關注與生產作為生物藥物的質粒時所涵蓋的屬性相同的屬性。這意味著必須制定同一性(例如序列、同質性)、效力(例如濃度、同質性)和純度(例如宿主雜質、生物負荷、殘留卡那霉素)的測定以及相應的驗收標準。
總結
大規模生產質粒的需求在過去幾年中激增,不僅是因為質粒生物藥物(例如用于 DNA 疫苗接種、體內基因治療和基因編輯的藥物)的發展,而且主要是因為它們在目前許多基因和細胞治療產品的生產中的支持作用,包括病毒載體、病毒載體疫苗、mRNA疫苗、微環/微載體/納米質粒和工程細胞。
除了目前的用途之外,可以預見的是,質粒可能會在 IVT 生產小 RNA 分子(例如反義寡核苷酸、RNA 向導、siRNA 產品)中發揮重要作用。雖然一開始人們可能會質疑 IVT 是否能夠與成熟的寡核苷酸化學合成相競爭,但朝這一方向發展的一個驅動因素可能來自一個意想不到的領域:農業。具體來說,基于通過 RNAi 在植物病原體和其它害蟲中誘導基因沉默的新型農藥工具的開發正在推動開發具有成本效益的方法來大量生產大量 dsRNA。鑒于化學合成很可能不適合實現 siRNA 所需的大規模和低成本生產,IVT 正在成為這種情況下的替代方案。
展望質粒生產方面,可以預見一些發展將促進或完全改變當今質粒的生產方式。例如,雖然目前大腸桿菌作為質粒生產宿主的表現看起來是無與倫比的,但人們可能會想,對質粒的高需求是否能證明尋找一種具有更適合生產特征的細菌宿主是合理的。革蘭氏陽性菌作為質粒生產宿主是有利的,因為它們缺乏脂多糖,脂多糖是從大腸桿菌中分離質粒時最麻煩的雜質之一。正如重組蛋白生產中出現了大腸桿菌以外的生產宿主一樣,可能還有其它宿主等待被發現并發展成質粒生產者。
質粒主鏈的工程也可能對該領域產生影響。此外,人們應該關注激進的創新,例如使用最小的合成結構,例如“狗骨”和啞鈴形 DNA 載體,它們是通過酶法生產的。然而,盡管這些代表了該領域的重要進步,但質粒在未來被淘汰的可能性很小。此外,小環、微載體和其它最小化載體的生產仍然依賴于質粒。
一次性技術、過程分析技術、自動化、數字化和連續生產是可能改變未來質粒生產方式的行業趨勢。例如,在后一種情況下,設計穩健且能夠持續遞送完整質粒的連續細胞裂解過程是另一個需要尋求的進步。
總之,質粒目前在許多基因和細胞治療產品的開發和生產中發揮的核心作用,充分證明了為提高其有效性和生產而大幅增加研發努力和投資的合理性。
原文:D.Prazeres, The supporting role of plasmids in gene & cell therapy. Cell & Gene Therapy Insights 2023; 9(5), 755–762.






