01
增溶、助溶及潛溶
(1)加入增溶劑
在水中加入表面活性劑,可增加難溶性藥物溶解度,這種現象稱為增溶,加入的表面活性劑稱為增溶劑(solubilizer)。許多藥物如揮發油、脂溶性維生素、甾體激素類、生物堿、抗生素類等均可用此法增溶。
(2)加入助溶劑
難溶性藥物加入助溶劑可因形成絡合物、復合物等而增加溶解度。如碘加碘化鉀可形成絡合物 KI3,而增加碘在水中的溶解度。咖啡因在水中的溶解度為 1:50,用苯甲酸鈉助溶形成分子復合物苯甲酸鈉咖啡因,水中溶解度增大。
(3)加入潛溶劑
混合溶劑是指能與水任意比例混合、與水分子能形成氫鍵結合并能增加它們的介電常數、能增加難溶性藥物溶解度的那些溶劑。如乙醇、甘油、丙二醇、聚乙二醇等與水組成混合溶劑。在混合溶劑中各溶劑在某一比例時,藥物的溶解度比在各單純溶劑中溶度解出現極大值,這種現象稱為潛溶,這種溶劑稱為潛溶劑。如苯巴比妥在90%乙醇中有最大溶解度。
02
鹽型和晶型的選擇
(1)制成可溶性鹽
難溶性弱酸和弱堿性藥物,可制成鹽而增加其溶解度。將含堿性基團的藥物如生物堿,加酸制成鹽類,以增加在水中溶解度。將酸性藥物加堿制成鹽增加水中溶解度。如乙酰水楊酸制成鈣鹽在水中溶解度增大,且比鈉鹽穩定。
(2)引入親水集團
難溶性藥物分子中引入親水基團可增加在水中的溶解度。如維生素 K3不溶于水,分子中引入-SO3HNa 則成為維生素 K3亞硫酸氫鈉,可制成注射劑。
(3)晶型
晶型不同導致晶格能不同,藥物的熔點、溶解速度和溶解度也不同,在多數情況下,溶解度和溶解速度的順序為:無定型﹥無水物﹥水合物。
03
其它技術手段
(1)固體分散技術
將難溶性藥物,通過熔融法、溶劑法等方式,使藥物以分子、膠體或超細粒子狀態分散于生理隋性而易溶于水的載體中,從而達到增溶、提效、穩定藥物、掩味、提高生物利用度等目的。其制備方法有熔融法、溶劑法、溶劑熔融法、研磨法、液相溶劑擴散法等。
固體分散物的增溶作用主要體現在兩個方面:首先是增加藥物的分散度,藥物在載體中以分子、膠態、微晶等狀態高度分散,粒子粒徑極小,藥物具有較好的溶解度。其次載體對藥物有抑晶性,具有可潤濕性,高度分散性,使藥物在固體分散物中以無定形或亞穩定型存在,處于高能狀態,可以提高藥物的溶解度和溶出度。用于固體分散物的材料很多,水溶性材料包括聚乙二醇類、聚維酮類、表面活性劑類、有機酸類、糖類與醇類;難溶性材料包括纖維素類、聚丙烯酸脂類和脂質類;還有腸溶材料纖維衍生物。利用不同性質的載體可以使藥物在高度分散狀態下,達到不同的用藥目的,水溶性高分子載體增加難溶性藥物的溶解度和溶出速率,從而提高藥物生物利用度。有研究顯示,將黃芩素制成固體分散體后大大提高了體外溶出度,根據大鼠體內的生物利用度可知,黃芩素固體分散體比其原料藥達峰時間短,達峰濃度高,相對生物利用度為164%。
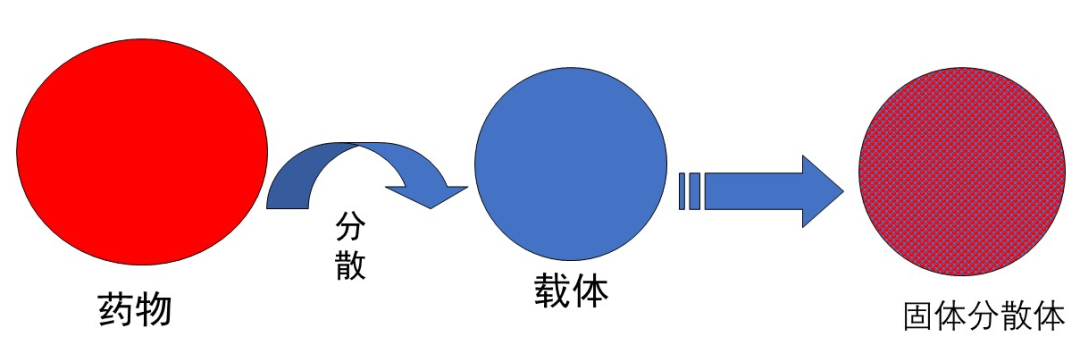
圖1:固體分散體示意圖
(2)環糊精包合法
環糊精包合法,通常是將客分子的部分基團或全部,以非共價鍵結合的方式,包被到主分子內形成的。包合物形成后,通常可以使客分子的理化參數發生改變,如溶解度、穩定性、不良氣味等。環糊精是由葡萄糖結合在一起形成的環狀低聚糖化合物。環糊精在不需要分子修飾的情況下,可以與藥物分子形成復合物,從而改善藥物的理化性質。
環糊精是由葡萄糖單元通過α-1,4糖苷鍵結合形成的環狀低聚糖,其具有親水性的外表面和親脂性的中心空腔。α-環糊精、β-環糊精和γ-環糊精是天然產物。未被取代的天然α-環糊精、β-環糊精和γ-環糊精雖然是親水性的,但在實際應用中,它們在水中的溶解性卻受到了一定的限制,特別是β-環糊精。因此,水溶性更好的β-環糊精衍生物,如2-羥丙基-β-環糊精被開發用于提高藥物在水中的溶解度。難溶性藥物與β-環糊精形成包合物后,藥物分子被包含于β-環糊精分子空腔中,具有很高的分散度,同時由于β-環糊精的親水性,使包合物具有良好的可潤濕性,因此增加藥物水溶性,改善其體外溶出特性和人體生物利用度。將β-環糊精接枝甲基、乙基、羥丙基等官能團,破壞β-環糊精分子內氫鍵的形成,可顯著改善其水溶性,使藥物的β-環糊精衍生物包合物溶解更快。如甲基環糊精、羥丙基環糊精、磺烷基化環糊精和硫酸化環糊精等。
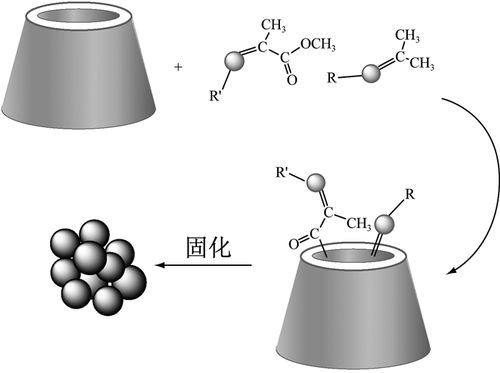
圖2:環糊精包合示意圖
(3)藥物的微粉化技術
藥物的溶解度與物料的比表面積有關,藥物的粒徑降低,藥物與介質的有效接觸面積增加,將提高藥物的溶解度和溶出速度。根據Noyes-Whitney方程,減小粒徑,增大比表面積,可增大飽和溶解度且提高溶出速率。微粉化技術解決了藥物在胃腸道吸收中關鍵的限速問題,促進了藥物在胃腸道中的吸收,提高了藥物的生物利用度。如灰黃霉素、醋酸炔諾酮微粉化處理后,可改善制劑溶出速率和生物利用度。適合微粉化的藥物不僅是化學合成藥,還有些蛋白質或多肽類藥物,如胰島素、干擾素、促紅素等。現有微粉化方法有機械粉碎、噴霧冷凍干燥、乳化冷凍干燥、超臨界流體技術。機械粉碎過程中,藥物的內在性質和外在性質發生改變。乳劑噴霧冷凍干燥更適宜于獲得較小粒徑的微粒。
(4)共晶技術
所謂藥物共晶,指的是活性藥物成分(API)和共晶形成物(CCF)在氫鍵或其他非共價鍵的作用下結合而成的晶體,其中,API 和 CCF 的純態在室溫下均為固體。而形成藥物共晶中的 CCF 可以包括生理上可接受的酸堿鹽和非離子化分子,如食品添加劑,防腐劑,藥用輔料,維生素、礦物質、氨基酸以及其他活性分子,甚至是其他的 API 等,他們可與 API 以氫鍵、π-π堆積、范德華力和其他非共價鍵相連而結合在同一晶格中。
從化學角度講,API 分子本身并未發生變化,因此還保持原有的藥效,而共晶藥物的溶解度,生物利用度,穩定性等方面卻會有極大的改善,尤其對于一些口服藥物制劑的發展有非常積極的作用。
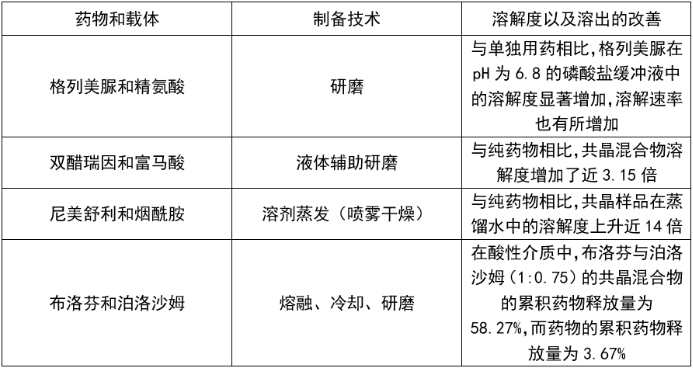
共晶藥物舉例:早在1844年和1893年,醌氫醌作為共晶的典型已經被文獻報道,但在30多年前才有較多的報道。目前藥物共晶在修飾API的理化性質方面的應用已經開始獲得關注。已經上市的藥物也有很多用共晶來研究,如:醋胺酚,布洛芬、阿司匹林、氟比洛胺酚等。而通過文獻進一步查詢發現,可獲得共晶形式的藥物還有咖啡因-檸檬酸、鹽酸氟西汀-鹵素原子、鹽酸丙咪嗪-苯甲酸,卡馬西平-丁二酸、氯唑沙宗-苯甲酸、吲哚美辛-糖精,茶堿-糖精、咖啡因-糖精、磺胺甲嘧啶-糖精、阿司匹林-糖精和卡馬西平-糖精,等等.... 共晶混合物溶解度以及溶解速率改善效果見下表。
表1. 共晶混合物溶解度以及溶解速率改善效果
04
總結
動物發病后,一般飲欲正常,采食會受到影響,因此獸用藥物的溶水性顯得異常重要。隨著規模化養殖的發展,加藥器的使用,對藥物的溶解度要求越來越高,同時更加關注其生物利用度、穩定性,甚至藥敏及藥物殘留等方面的問題。因此,如何使用好這些技術與方法,提高藥物溶解度,從而最大限度地發揮療效,是讓更多藥物更好地造福廣大養殖戶的關鍵。
來源:國家動物保健品工程技術研究中心






